Den 5. juli lancerede Novo Nordisk et fase III klinisk forsøg med CagriSema-injektion i Kina, hvis formål er at sammenligne sikkerheden og effekten af CagriSema-injektion med semeglutid hos fede og overvægtige patienter i Kina.
CagriSema-injektion er en langtidsvirkende kombinationsterapi under udvikling af Novo Nordisk, hovedkomponenterne er GLP-1 (glucagon-lignende peptid-1) receptoragonist smeglutid og en langtidsvirkende amylinanalog cagrilintid.CagriSema-injektion kan administreres subkutant en gang om ugen.
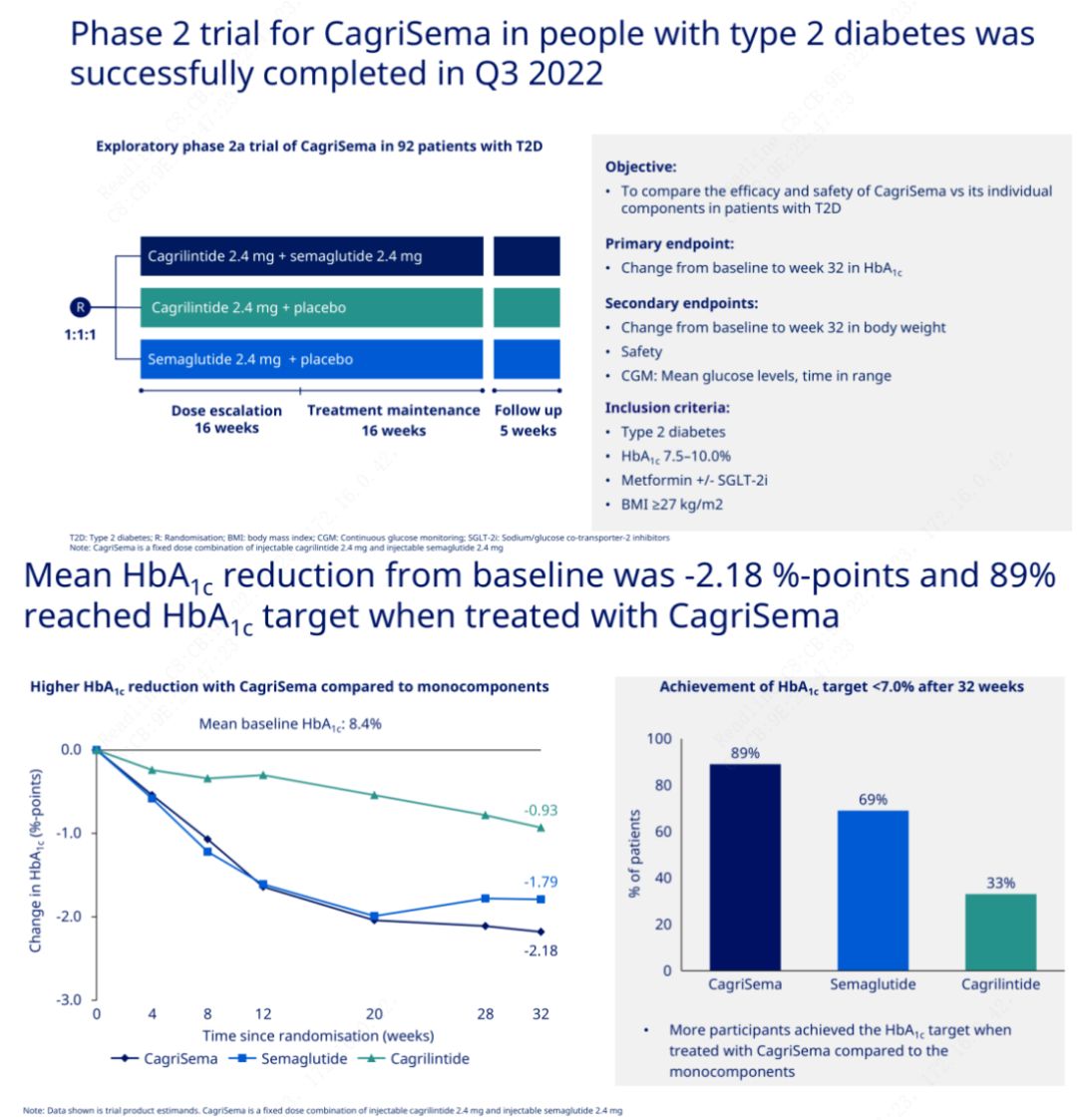
Det primære formål var at sammenligne CagriSema (2,4 mg/2,4 mg) med semeglutid eller placebo en gang om ugen subkutant.Novo Nordisk har offentliggjort resultaterne af et forsøg med CagriSema til behandling af fase 2-diabetes, som beviste, at CagriSemas hypoglykæmiske effekt er bedre end semeglutid, og næsten 90 % af forsøgspersonerne har nået HbA1c-målet.
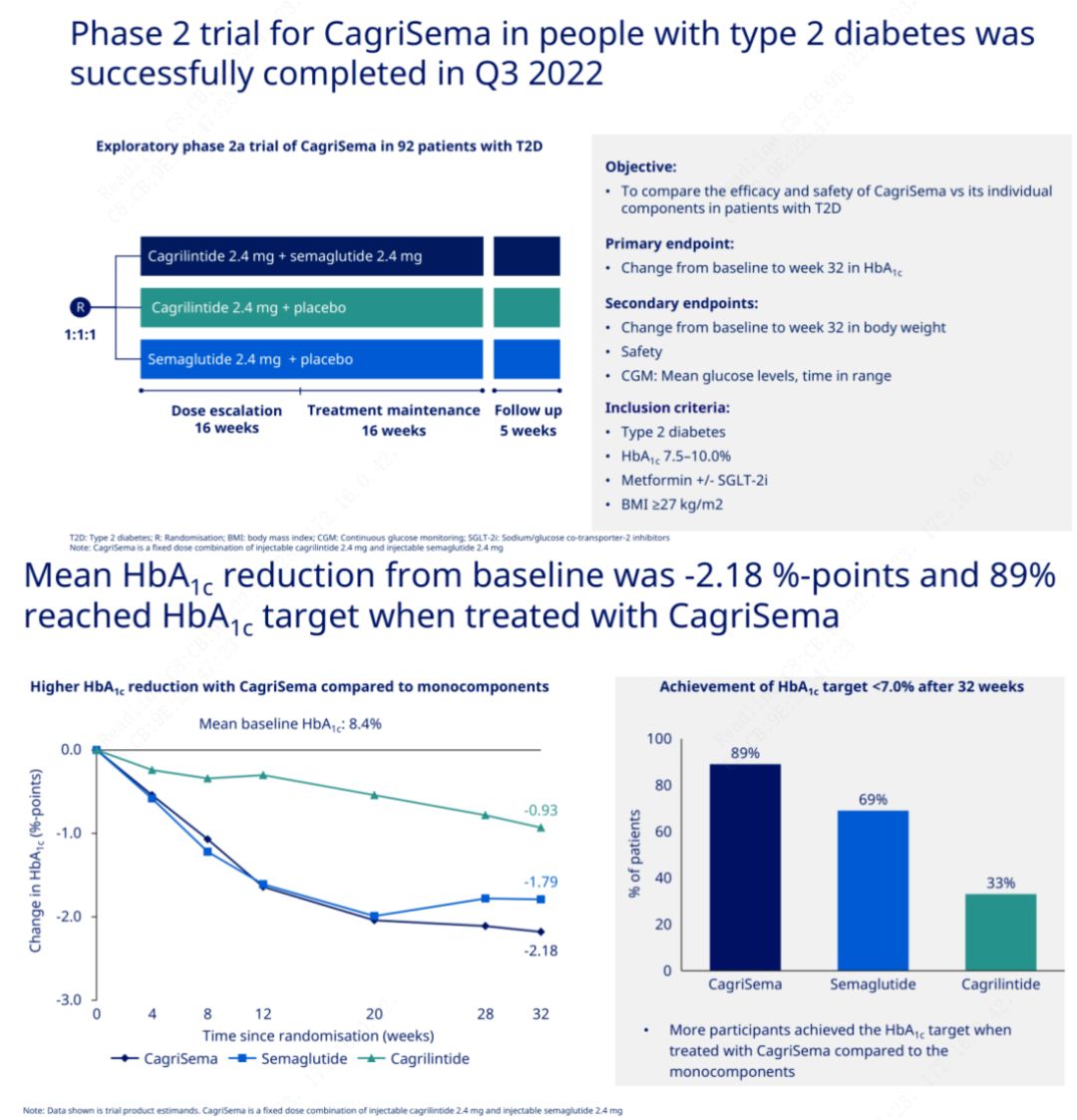
Dataene viste, at ud over den signifikante hypoglykæmiske effekt, hvad angår vægttab, overgik CagriSema-injektion markant semeglutid (5,1 %) og cagrilintid (8,1 %) med et vægttab på 15,6 %.
Det innovative lægemiddel Tirzepatide er verdens første godkendte ugentlige GIP/GLP-1-receptoragonist.Det kombinerer virkningerne af to inkretiner i et enkelt molekyle, der injiceres en gang om ugen og er en ny klasse af behandlinger for type 2-diabetes.Tirzepatide blev godkendt af US Food and Drug Administration (FDA) i maj 2022 til at forbedre glykæmisk kontrol (på diætbasis og motion) hos voksne med type 2-diabetes og er i øjeblikket godkendt i EU, Japan og andre lande.
Den 5. juli annoncerede Eli Lilly et fase III SURPASS-CN-MONO-studie om registrerings- og informationsplatformen for kliniske lægemidler til behandling af type 2-diabetespatienter.SURPASS-CN-MONO er et randomiseret, dobbeltblindt, placebokontrolleret fase III studie designet til at evaluere effektiviteten og sikkerheden af tirzepatid monoterapi sammenlignet med placebo hos personer med type 2 diabetes.Undersøgelsen planlagde at omfatte 200 patienter med type 2-diabetes, som ikke var på nogen antidiabetika i de 90 dage forud for besøg 1 (undtagen i visse kliniske situationer, såsom akut sygdom, hospitalsindlæggelse eller elektiv kirurgi, kortvarig (≤14) dage) brug af insulin).
Type 2-diabetes forventes at blive godkendt i år
Sidste måned blev resultaterne af et SURPASS-AP-Combo-studie offentliggjort den 25. maj i det storslåede tidsskrift Nature Medicine.Resultaterne viste, at sammenlignet med insulin glargin viste Tirzepatide bedre HbA1c og vægtreduktion i populationen af type 2-diabetespatienter i Asien-Stillehavsområdet (hovedsageligt Kina): HbA1c-reduktion på op til 2,49 % og vægtreduktion på op til 7,2 kg (9,4 %) efter 40 ugers behandling, signifikant forbedring af blodlipider og blodtryk og den generelle sikkerhed og tolerabilitet var god.
Det kliniske fase 3-forsøg med SURPASS-AP-Combo er Tirzepatides første undersøgelse, der hovedsageligt er udført i kinesiske patienter med type 2-diabetes, ledet af professor Ji Linong fra Peking University People's Hospital.SURPASS-AP-Combo er i overensstemmelse med resultaterne af den globale SURPASS-forskningsserie, som yderligere beviser, at patofysiologien af diabetes hos kinesiske patienter er i overensstemmelse med globale patienters, hvilket er grundlaget for den samtidige forskning og udvikling af nye lægemidler i Kina og verden, og giver også solid evidensstøtte til at give kinesiske patienter mulighed for at bruge de nyeste diabetesbehandlingsmidler og deres kliniske anvendelse i Kina så hurtigt som muligt.
Indlægstid: 18. september 2023

